A 2017-es év tavaszi félévének első Élő Adás előadásán egy érdekes, merőben elgondolkoztató immunológiai témával látták vendégül az érdeklődőket a szervezők. Egy evolúciós szempontból is jelentős fogalommal, a sokarcú komplementrendszerrel ismerkedhettünk meg.
Röviden a bemutatás és felkonferálás előtt, Dr. Müller Viktor megosztotta velünk, hogy március 29-én lesz a következő előadás Evolúciós magyarázatok a mai pszichológiában címmel, Bereczkei Tamás professzor úr tolmácsolásában. A performanszra minden érdeklődőt szeretettel várnak. Ezt követően az előadáson megjelenő nagyérdemű az alapfogalmaktól kezdve ismerkedhetett meg átfogóan az immunológia, részleteiben pedig többnyire a veleszületett immunitáshoz tartozó komplementekről.
Dr. Józsi Mihály
1997-ben végzett az ELTE-n biológus és angol szaknyelvi fordítóként. Ugyanitt szerezte meg 2002-ben a PhD fokozatát immunológiából. Jelenleg az Immunológiai Tanszék tudományos főmunkatársa és az MTA-ELTE Lendület Komplement Kutatócsoport vezetője. Emellett jó pár díj és ösztöndíj nyertese.
Az immunitás Janus alakja
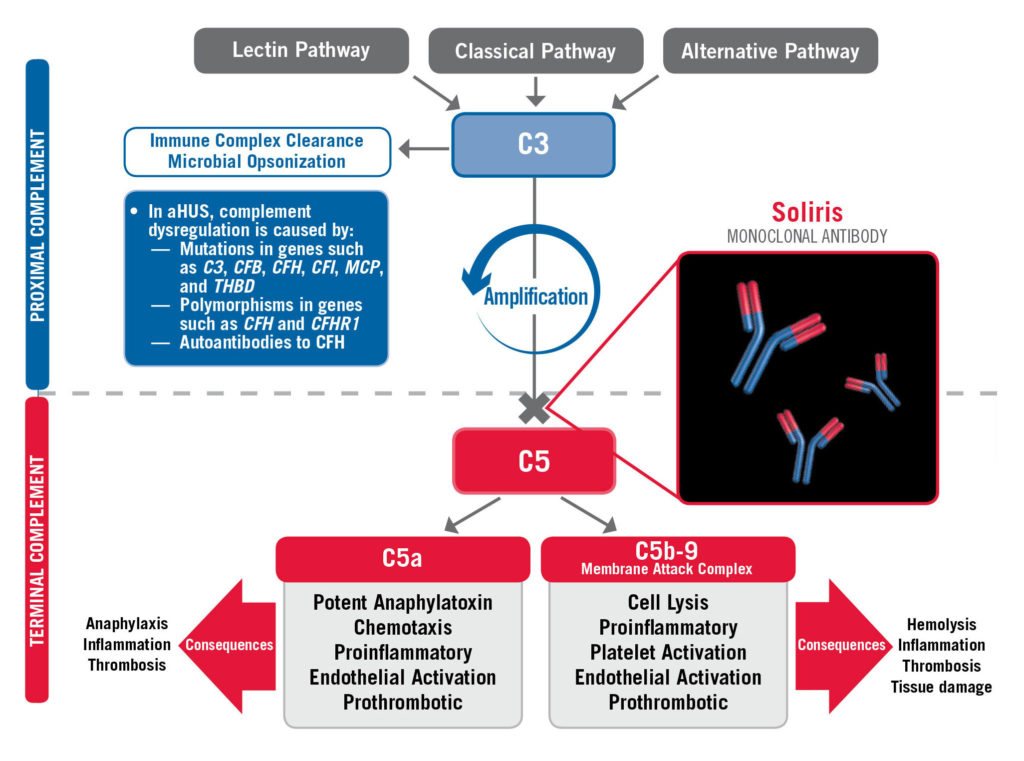
Az immunrendszer legfőbb feladata a szervezet hatékony védelme a fertőzések ellen. A szó etimológiája is a védettséget és a mentességet jelenti. Ezen felül védelmet nyújt egyes tumorok ellen is. Ennek szerepköre hatalmas és sok más előadást lehetne róla tartani. Az immunrendszernek a szerepe nem csak a betegségekben nyilvánul meg, hanem a terápiás vonatkozások ismeretében is. Hibás működése további betegségeket okozhat, illetve a helyes működés következménye akár a gátja lehet egy esetleges szervtranszplantációnak (graft-versus-host és host-versus-graft betegség). Az immunrendszer általános osztályozásába beletartozik a veleszületett és az adaptív immunitás. Az előbbi sejtes elemein felül a vérplazmában található egy hálózat (komplementek). Feladatuk, hogy más közreműködőkkel együtt az idegen elemeket elpusztítsák. A komplementeknek az adaptív immunitásban is vannak bizonyos szerepei. A XVIII. században Galántai Fodor József fontos szerepet töltött be ennek a rendszernek a felfedezésében. A XIX. század végére jött a felismerés, hogy az ellenanyagok önmagukban nem elegendőek, szükséges egy másik, szérumban lévő faktor is. Az elnevezés Jules Jean-Baptiste Vincent Bordet belga immunológustól származik, aki 1919-ben kapta meg az orvosi Nobel-díjat az immunitáshoz kapcsolt felfedezéseiért. Jelen állás szerint a komplementekhez több mint 40 fehérjét sorolnak. Ezek együttes működése biztosítja a hatékony reaktivitást. Inaktívan testszerte jelen vannak a vérben és egyéb testfolyadékokban. Aktivációjuk kaszkádszerűen (lépésről lépésre) megy végbe. Funkciójuk szerteágazó, de végső szempont szerint a mikrobák lízise és opszonizációja, kemotaxis, gyulladás kiváltása, bizonyos sejtek aktiválása, az autoreaktív B-sejtek eliminálása. Ide tartoznak még egyes élettani folyamatok, mint például az immunkomplexek eltávolítása, az apoptotikus és nekrotikus sejtek eltávolítása, az érképződés, és a méhlepény fejlődése. Az aktiválódási útvonalak is többfélék lehetnek: a klasszikus út, amely az ellenanyag jelenlétét előfeltételezi, a lektin út, amelyben különböző szénhidrátfelismerő mechanzimusok vannak, és az alternatív út, amelyben mintázatfelismerő molekulák vannak. Mindháromban a közös lépéshez tartozik az opszonizáció és a fagocitózis. A következő lépésben már gyulladási mediátorok is felszabadulnak. Ha a védekezés során a célsejtek membránját átfúrják és azokat feloldják, akkor beszélünk a lízis folyamatáról. Az opszonizációt pedig leginkább úgy lehetne leírni, ahogy George Bernard Shaw irodalmi Nobel-díjas drámaíró fogalmazott róla. Az opszonizáció olyan, mint a vaj vagy a lekvár, amit a kenyérre kenünk, hogy nagyobb étvágyunk legyen. Az opszonizált patogénnek fokozottabb a fagocitózisa. Itt fontos szempont, hogy a védelmi rendszerünk milyen stratégiát alkalmaz. Különbséget kell tenni a saját és a nem saját felismerésében. Ez viszonylag bonyolult, ugyanis nehéz végtelen mennyiségű receptort előállítani. Emiatt van egy másik stratégia is, amelynek a lényege minden megtámadása, de a saját védelme. Az alternatív út során a saját sejtjeinket különböző szabályozó molekulák megvédik a komplementek károsító hatásától.
A komplementrendszernek hatalmas szerepe van a szisztémás és szervspecifikus betegségekben, az idegrendszertől kezdve a légzésen át a kiválasztószervrendszeri elégtelenségekig. Van egy 155 kDa-os komplement regulátor fehérje, a H-faktor, ami az egyik fontos komponensnek, a C3b aktivációját gátolja. Feladata, hogy a szérumban és az egyéb testfolyadékokban meggátolja a komplement aktivációt. Képes az extracelluláris mátrixhoz és sejtek alapmembránjához kikötődni. Ez a szérummolekula citoprotektív hatással is bír. Sajnos akadnak, olyan mikrobák, amelyek begyűjtik és megkötik a H-faktort és így támadnak meg. Ha a H faktor nem kötődik a saját sejteken, akkor a szövetek károsodást szenvednek. Viszont a mikrobák is eliminálódhatnak. A H faktor nem található meg egyedül, vannak testvérmolekulái. A kötődésért felelős domének megegyeznek. Ezek feltehetően génduplikációk révén jöttek létre. A CFHR (Complement Factor H Related proteins) gének és betegségek kapcsolata már bizonyított az atípusos haemolitikus uréniás szindróma (aHUS), a szisztémás lupus erythematosus (SLE) és a Neisseria meningitidis által okozott járványos agyhártyagyulladás esetében. A komplementdeficiens személyek különösen fogékonyak.
Az időskori maculadegeneratio (AMD)
Az AMD a nyugati világban a vakság és a látásromlás vezető oka, prevalenciája 3%-os. Kiváltó okai az öregedés, az oxidatív stressz, a gyulladás, a dohányzás, a napfény és akadnak genetikai komponensek. Az életmódbeli és környezeti faktorok mellett gyakran a genetikai faktor is közrejátszik. Ennél a betegségnél előforduló H-faktor polimorfizmus (Y402H) szelekciós előnyt jelenthet, ugyanis vannak olyan kórokozók, amelyek így nem tudják megkötni.
A-típusos haemolitikus uréniás szindróma (aHUS)
Az aHUS nagyon ritka betegség. Évente 1-2 eset fordul elő Magyarországon. A kimenetele potenciálisan halálos, ugyanis a vese, az agy és egyéb szervekben található kapillárisok eltömődnek a microthormbusok által. A komplementaktiváció szabályozásának hibájával függ össze. Genetikai szempontból ez egy gain-of-function (funkciónyeréses) mutáció a C3 molekulában. Kezelése plazmaferezissel, gyulladásgátlók adásával, immunszupressziv, anti-C5 kezeléssel történik. A mutációk elsősorban a molekula C-terminálisán találhatóak. Az anti-C5 (soliris, eculizumab) egy olyan monoklonális antitest, amely a gyulladáskeltő irányba tolja az aktivációs útvonalat. 2011-ben engedélyezték erre a betegségre. A világ legdrágább gyógyszereként tartják számon. 2 hetente kell adni az ellenanyagot, hogy folyamatosan gátlás alatt legyen a komplementrendszer, s emellett a betegeket kötelező jelleggel beoltják Neisseria ellen. Sajnos ez sem túl kockázatmentes kezelés, de az esélyeket némiképp így is javítja.